Approfondimento
Osteoporosi: premesse cliniche
| Il materiale scientifico presentato sul sito è indirizzato agli operatori del settore interessati alle patologie vertebrali. Per i pazienti le informazioni disponibili in queste pagine hanno solo un valore indicativo e non possono sostituire un parere medico. |
- Introduzione
- Osteoporosi, osteopenia, osteomalacia
- Fattori di rischio
- Classificazione
- Metabolismo osseo
- Tecniche di misurazione della massa ossea
- Mineralometria Ossea Computerizzata (MOC)
- Densitometria a singolo raggio fotonico (SPA)
- Densitometria a doppio raggio fotonico (DPA)
- Densitometria digitale a raggi X (DEXA)
- Tomografia Assiale Computerizzata Quantitativa (QCT) ed Attivazione Neutronica (AN)
- Scelta del metodo di misurazione della massa ossea
- Iter diagnostico per osteoporosi postmenopausale
- Prevenzione
- Per ulteriori notizie: www.isico.it/approfondimenti.htm
Introduzione
-
L'osso (figura 1) è un organo che dà forma al corpo, ne sostiene il peso e ne facilita la locomozione fornendo ai muscoli l'inserzione per agire come leve. E' inoltre in grado di reagire elasticamente alle forze meccaniche e, se si rompe, ripara sé stesso riacquistando la sue forma originaria. L'osso è anche un particolare tessuto mineralizzato "composito", al pari del cemento armato; è costituito da una matrice organica di fibre collagene (proteine) disperse in una massa inorganica di minerali (idrossiapatite di calcio).
Nonostante la sue durezza, e quindi l'apparente staticità, l'osso è estremamente dinamico ed in continua evoluzione. Avvengono infatti costantemente due processi, uno di lenta neodeposizione e l'altro, più rapido, di riassorbimento. E' così consentito:
- un perenne rimodellamento della struttura macro e microscopica;
- uno scambio con tutti i tessuti dell'organismo attraverso il mezzo di trasporto garantito dal sangue.
E' quindi possibile raggiungere un equilibrio dinamico tra le esigenze corporee di calcio e le necessità di sostegno del carico.
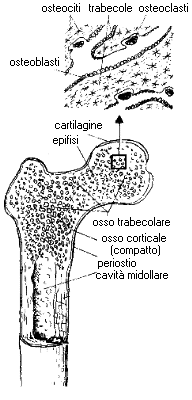
Figura 1
Composizione dell'ossoQueste caratteristiche, finemente regolate da diversi fattori, dipendono essenzialmente dalle cellule ossee, che sono:
- gli osteoblasti, che sintetizzano la matrice organica e favoriscono la deposizione minerale, e che si trovano direttamente appoggiati all'interno delle superfici ossee in accrescimento come singolo strato di cellule cubiche;
- gli osteociti, che derivano dagli osteoblasti, e che sono inclusi nel tessuto mineralizzato entro le lacune ossee, collegati tra loro da un'estesa maglia di ramificazioni; apparentemente inattivi, probabilmente partecipano al rilascio in circolo del calcio;
- gli osteoclasti, che hanno il compito di riassorbire osso, e che sono grosse cellule macrofagiche multinucleate che si trovano in corrispondenza delle cosiddette lacune di Howship da esse stesse create nel processo di riassorbimento.
L'osso può assumere due diverse organizzazioni spaziali. La compatta o corticale (figura 2):
- rappresenta l'80% dello scheletro;
- è componente quasi esclusiva delle ossa lunghe e piatte;
- assume nelle ossa lunghe forma tubolare, delimitando il canale midollare;
- è rivestita all'esterno dal periostio ed all'interno dall'endostio;
- ha un comportamento anisotropo, presenta cioè maggiore resistenza alle forze applicate secondo il suo asse verticale;
- ha una densità di 1,8 g/cm3.
L'osso trabecolare o spugnoso (figura 3):
- è organizzato in trabecole, prevalentemente orientate in senso perpendicolare tra loro;
- le trabecole verticali sono più grosse e sopportano il carico;
- le trabecole orizzontali stabilizzano le verticali;
- la parte di spazio non occupata da tessuto osseo è costituita da midollo ematopoietico e tessuto adiposo;
- la sua densità può variare tra 0,1 ed 1 g/cm3.
Tra i due, il tessuto osseo trabecolare ha un grosso rilievo clinico, perché è l'osso meno denso. La resistenza alla compressione aumenta infatti in modo proporzionale al quadrato della densità. Le fratture avvengono quindi in sedi in cui l'osso spugnoso è percentualmente più rappresentato.
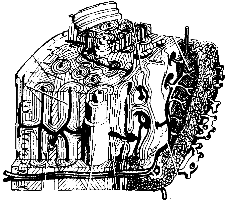
Figura 2
Struttura dell'osso corticale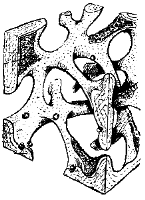
Figura 3
Struttura dell'osso trabecolareDi estremo interesse infine è il grafico dell'evoluzione della massa ossea nel corso della vita nei due sessi (figura 4). Possiamo per comodità espositiva e didattica considerare alcune fasi.
La fase di incremento della massa ossea segue a grandi linee l'andamento della crescita staturale, anche se dura di più:
- caratterizza le prime due decadi di vita;
- c'è un momento di massima ascesa durante l'adolescenza;
- è analoga nei due sessi, anche se a partire dalla pubertà c'è una differenziazione progressiva.
Si perviene quindi ad un periodo di consolidamento, caratterizzato da una continua, lenta ascesa fino ai 35-40 anni di età.
Si raggiunge così il "picco di massa ossea", cioè la massima quantità d'osso relativa a ciascun individuo: la differenza tra i due sessi è a questo punto evidente.
Da questo momento in poi la massa ossea si riduce ed inizia la fase di decremento. che prosegue per tutta la vita. Qui le differenze in base al sesso sono marcate. Nelle donne, infatti, la diminuzione:
- è più precoce;
- coincide con la menopausa;
- sembra assumere un andamento spezzato, secondo un modello lineare (prima della menopausa) /esponenziale inverso (dopo la menopausa) (figura 4c).
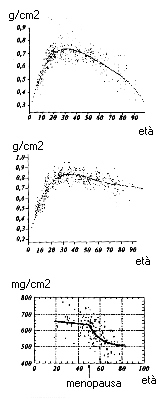
Figura 4
Curva di discesa dei valori di contenuto minerale osseo a livello appendicolare in fennime (a) e maschi (b) in rapporto all'età cronologica: valori dei singoli soggetti e valore medio. (c) Curva di perdita del contenuto minerale osseo dell'avambraccio in 162 donne sane sia in pre- che in post-menopausa. Dopo i 50 anni il grafico è in relazione all'età aggiustata per la menopausa.Val qui la pena quantificare la diminuzione di massa ossea in questo periodo cruciale nella vita della donna. Dopo la menopausa il tasso medio di perdita è:
- nei primi tre anni del 2,9% nelle vertebre e del 2,0% nell'avambraccio;
- nei primi dieci anni del 1,6% nelle vertebre e del 1,2% nell'avambraccio;
- nelle donne andate in seguito incontro a fratture si stima nel 4% all'anno nelle vertebre e nel 2,9% nell'avambraccio.
La perdita d'osso legata all'invecchiamento, che si svolge in un arco di tempo di circa 40 anni, è quindi sufficiente a portare una quota di uomini e di donne, peraltro normali, in una situazione di particolare fragilità ossea che li predispone a fratture anche per eventi traumatici minimi.
Osteoporosi, osteopenia, osteomalacia
Dopo quanto detto, apparirà più semplice comprendere la differenza esistente fra osteopenia ed osteoporosi. Una certa quantità di massa ossea si riduce fisiologicamente ed inevitabilmente con l'età: tale riduzione viene definita osteopenia; quando il processo demineralizzante diventa particolarmente intenso e prolungato al punto da determinare fratture per traumi di modesta entità, si parla di osteoporosi. L'osteoporosi è quindi una malattia demineralizzante sistemica caratterizzata da un ridotto volume di tessuto osseo, la cui composizione minerale rimane però normale; si tratta quindi di una alterazione essenzialmente quantitativa ed in questo si differenzia dall'osteomalacia, che presenta invece una alterazione qualitativa, per difetto di mineralizzazione della matrice proteica.
Fattori di rischio
Il sesso, la razza, i caratteri costituzionali di un individuo, le variazioni di complessi sistemi endocrini in relazione a fenomeni come la menopausa e l'invecchiamento, interagendo con cause ambientali, quali abitudini dietetiche, attività fisica, fumo, alcool, possono determinare lo sviluppo di una condizione di osteoporosi (Tabella 1).
La predisposizione del sesso femminile per l'osteoporosi dipende innanzitutto dal fatto che le donne possiedono una massa ossea minore rispetto agli uomini e, secondariamente, dal fatto che la carenza di ormoni sessuali (estrogeni), che inizia con la menopausa, determina nelle donne una perdita di massa ossea più precoce e maggiore che negli uomini.
Una menopausa chirurgica (asportazione di entrambe le ovaie) determina una immediata riduzione degli estrogeni e quindi una rarefazione ossea più veloce. Una menopausa precoce (prima dei quarantacinque anni) può determinare una riduzione della massa ossea con qualche anno di anticipo rispetto a quanto avviene normalmente.
| Età avanzata |
| Sesso femminile |
| Razza caucasica o asiatica |
| Costituzione magra |
| Fattori menopausali Menopausa precoce Menopausa chirurgica |
| Abitudini di vita Insufficiente apporto dietetico di calcio Scarsa attività fisica Fumo di sigaretta |
Principali fattori di rischio per l'osteoporosi
Una costituzione esile, una carnagione chiara si accompagnano molte volte a fenomeni più o meno marcati di riduzione della densità ossea. Una storia familiare positiva (genitori o nonni affetti da osteoporosi, o che hanno avuto durante la loro vita fratture multiple) sembra poter indicare la predisposizione allo sviluppo di tale malattia, sia per caratteri costituzionali che per abitudini alimentari ed ambientali.
Un regime dietetico povero di calcio, di latte e dei suoi derivati, favorisce una progressiva riduzione della densità ossea. Un'alimentazione povera di questo minerale è ancora più dannosa in particolari situazioni, come nella gravidanza (il calcio è necessario per il feto) e durante l'allattamento (il calcio passa al bambino attraverso il latte materno). E' inoltre dannosa nelle persone anziane, nelle quali l'assorbimento intestinale di questo minerale subisce fisiologicamente un rallentamento, favorendo l'instaurarsi dell'osteoporosi. Il fumo ha un effetto negativo sull'osso e sembra possa determinare l'insorgenza anticipata della menopausa. L'abuso di alcool determina un aumento del rischio di osteoporosi. L'eccesso di proteine alimentari, introdotte con la dieta, favorisce una maggior perdita di calcio con le urine. La vita sedentaria favorisce una progressiva riduzione della massa ossea.
Classificazione
Esistono numerose classificazioni dell'osteoporosi, a seconda che si consideri il meccanismo patogenetico, l'età di insorgenza, l'associazione con altre patologie, i distretti scheletrici interessati, etc.. Una prima semplice classificazione consiste nel dividere le osteoporosi primitive da quelle secondarie; queste ultime possono a loro volta essere sistemiche o distrettuali (Tabella 2).
| Osteoporosi primitive | Giovanile | |
| Idiopatica dell'età adulta | ||
| Post-gravidica | ||
| Post-menopausale | ||
| Senile | ||
| Osteoporosi secondarie sistemiche | Malattie endocrine | Cushing ipertiroidismo iperparatiroidismo etc. |
| Malattie gastrointestinali | malassorbimenti gastrectomia epatopatie etc. |
|
| Malattie ematologiche | mieloma multiplo leucemie etc. |
|
| Malattie del tessuto connettivo | osteogenesi imperfetta Sindrome di Marfan etc |
|
| Malattie reumatiche | artrite reumatoide altre malattie del collageno |
|
| Da farmaci | corticosteroidi antiepilettici eparina etc |
|
| Da ridotto stimolo meccanico | ||
| Osteoporosi secondarie distrettuali | Post-traumatiche | |
| Da disuso | ||
| Algo-neuro-distrofie | ||
Classificazione delle osteoporosi
Pochi cenni sulle forme primitive, che sono responsabili di oltre l'80% delle osteoporosi, per la massima parte dovute alle forme postmenopausale e senile (Tabella 3).
| Postmenopausale (Tipo I) | Senile (Tipo II) | |
| Fattori epidemiologici | ||
| Età | Da 55 a 75 anni | > 70 anni (F); > 80 anni (M) |
| Rapporto in base al sesso (F/M) | 6/1 | 2/1 |
| Fisiologia o metabolismo dell'osso | ||
| Patogenesi del disaccoppiamento | Attività osteoclastica aumentata, maggior riassorbimento | Attività osteoblastica diminuita, diminuita deposizione |
| Perdita ossea totale | Principalmente trabecolare | Corticale e trabecolare |
| Velocità della perdita ossea | Rapida, di breve durata | Lenta, di lunga durata |
| Densità ossea | > 2 deviazioni standard sotto la norma | inferiore alla norma (riferita all'età ed al sesso) |
| Segni clinici | ||
| Sedi di frattura | Vertebre (schiacciamento), polso, anca (intracapsulare) | Vertebre (cunei multipli), parti prossimali dell'omero e della tibia, anca (extracapsulare) |
| Altri segni | Perdita dei denti | Cifosi dorsale |
| Dati di laboratorio | ||
| Calcemia | Normale | Normale |
| Fosforemia | Normale | Normale |
| Fosfatasi alcalina | Normale (aumentata in presenza di fratture) | Normale (aumentata in presenza di fratture) |
| Calciuria | Aumentata | Normale |
| Attività del paratormone | Diminuita | Aumentata |
| Conversione renale della Vit. D: da 25(OH)D3 a 1,25 (OH)2D3 | Secondariamente diminuita per la diminuzione di paratormone | Primitivamente diminuita per la diminuita risposta enzimatica |
| Assorbimento gastro-intestinale di calcio | Diminuito | Diminuito |
Caratteristiche dei due tipi principali di osteoporosi primitive
Le osteoporosi giovanile ed idiopatica dell'età adulta presentano una patogenesi ancora assai oscura. Quella giovanile si manifesta durante l'epoca dello sviluppo ed è spesso di tipo transitorio, con recupero dopo pochi anni.
L'osteoporosi postgravidica, alla quale alcuni autori associano anche una forma da allattamento, è meno rara. Può essere facilitata da una dieta povera di calcio durante gli ultimi mesi di gravidanza, o da una inefficiente regolazione ormonale del metabolismo calcico.
Metabolismo osseo
Il tessuto osseo è estremamente attivo ed interagisce continuamente con l'ambiente che lo circonda. In effetti una delle sue funzioni è quella di offrire una riserva del calcio per l'organismo per mantenere costante la quantità di questo minerale nel sangue (calcemia) e quindi negli altri tessuti.
Il calcio infatti ha una funzione essenziale nella regolazione fine di alcuni processi vitali:
- metabolismo: attivazione cellulare, trasporto di membrana, funzione enzimatica, risposta agli ormoni, funzione tubolare renale;
- funzione ghiandolare: secrezione esocrina ed endocrina;
- conduzione nervosa: centrale e periferica
- contrazione muscolare: muscolo volontario, liscio e cardiaco;
- coagulazione: funzione piastrinica e cofattore nella cascata coagulativa;
- integrità cutanea.
Senza addentrarci in particolari, per cui rimandiamo a testi più approfonditi, ci limitiamo qui a riportare il normale funzionamento del cosiddetto metabolismo fosfocalcico, in quanto i due ioni sono tra loro strettamente collegati.
Ricordiamo inoltre di seguito brevemente le caratteristiche di alcuni ormoni (paratormone e calcitonina) che regolano questo metabolismo ed alcuni fattori di rimaneggiamento osseo (osteocalcina e Vitamina D) (Tabella 4).
| Ormone paratiroideo (PTH), peptide | 1,25(OH)2D3 (Vitamina D), steroide | Calcitonina, peptide | |
| Origine | Cellule principali delle ghiandole paratiroidi | Tubulo prossimale renale | Cellule parafollicolari della ghiandola tiroide |
| Produzione | |||
| Fattori stimolanti | Ipocalcemia | Aumento di PTH Ipocalcemia Ipofosfatemia |
Ipercalcemia |
| Fattori inibenti | Ipercalcemia Aumento di Vitamina D |
Diminuzione di PTH Ipercalcemia Iperfosfatemia |
Ipocalcemia |
| Organi bersaglio | |||
| Intestino | Nessun effetto diretto Azione indiretta: stimola l'idrossilazione renale della Vitamina D |
Stimola notevolmente l'assorbimento di Calcio e Fosforo | ? |
| Rene | Stimola la 25 alfaidrossilasi Aumenta il riassorbimento del Calcio filtrato Aumenta l'escrezione urinaria di Fosforo |
? | ? |
| Osso | Stimola il riassorbimento osteoclastico Stimola il reclutamento dei preosteoclasti |
Stimola notevolmente il riassorbimento osteoclastico | Inibisce il riassorbimento osteoclastico (?) azione fisiologica normale nell’uomo (?) |
| Effetto totale | |||
| Concentrazioni di Calcio e Fosfati nel siero e nel liquido extracellulare | Ipercalcemia Ipofosfatemia |
Ipercalcemia Iperfosfatemia |
Ipocalcemia (transitoria) |
Regolazione del metabolismo fosfocalcico
Il paratormone (PTH) è prodotto dalle cellule principali delle paratiroidi. La secrezione del PTH avviene in risposta a bassi livelli di calcemia e determina ipercalcemia, ipofosforemia, ipercalciuria e iperfosfaturia.
Il PTH agisce su tre organi bersaglio:
- a livello osseo promuove la mobilizzazione del calcio dallo scheletro con vari meccanismi: stimola gli osteoclasti ed aumenta il loro numero; stimola gli osteociti a secernere enzimi proteolitici, che provocano il riassorbimento della matrice proteica; probabilmente inibisce gli osteoblasti;
- a livello renale diminuisce il riassorbimento del fosforo da parte del tubulo prossimale, abbassando così la fosforemia; aumenta inoltre il riassorbimento di calcio a livello del tubulo distale;
- a livello intestinale influisce in modo indiretto sull'assorbimento intestinale del calcio, in quanto stimola a livello renale l'idrossilazione della 25(OH)D3: si ottiene così la 1,25 (OH)2D3, il metabolita più attivo della vitamina D, che agendo a livello intestinale aumenta l'assorbimento di calcio e fosforo.
La calcitonina viene prodotta dalle cellule parafollicolari, o cellule C, della tiroide. La sua secrezione è provocata in risposta ad alti livelli di calcemia, determinando ipocalcemia e ipercalciuria.
La calcitonina agisce a due livelli:
- a livello osseo: inibisce il riassorbimento periosteocitario, diminuisce il numero e l'attività degli osteoclasti, previene l'osteolisi indotta dal PTH;
- a livello renale: determina un aumento della clearance renale del calcio e del fosforo.
L'osteocalcina (GLA) è una proteina ossea considerata marker specifico del metabolismo osseo. La GLA lega gli ioni calcio ed ha affinità per l'idrossiapatite, per cui si ritiene che possa intervenire nella fase di mineralizzazione ossea, anche se il suo ruolo specifico in questo processo non è ancora noto. Essa viene prodotta dagli osteoblasti sotto il controllo dell'1,25(OH)2D3, passa in circolo e viene escreta per filtrazione renale. Valori elevati di osteocalcina si riscontrano in genere nelle condizioni in cui vi sia un rimodellamento osseo ed un aumento dei livelli di 1,25(OH)2D3. Vi sono, invece, valori diminuiti quando sussiste un difetto di mineralizzazione, una diminuita attività ossea e bassi livelli di 1,25(OH)2D3.
Per vitamina D si intende un gruppo di composti di natura steroidea che a tutti gli effetti possono essere inquadrati come ormoni. Le principali vitamine D sono:
- la vitamina D2, o ergocalciferolo, che deriva dall'ergosterolo, composto di origine vegetale;
- la vitamina D3, o colecalciferolo, che deriva dal 7-deidrocolesterolo (7DHC), composto di origine animale.
La vitamina D2 si ottiene per irradiazione dell'ergosterolo e va incontro alle stesse modificazioni metaboliche della vitamina D3. I fabbisogni quotidiani di vitamina D sono di 400-800 unità nell'infanzia e di 100 unità nella vita adulta. In un recente studio è stato evidenziato come i livelli di 25(OH)D3 e 1,25(OH)2D3 non diminuiscono con l'età in entrambi i sessi e non subiscono variazioni stagionali. L'apporto alimentare è scarso, l'assorbimento intestinale avviene a livello digiuno-ileale, dove la vitamina D viene incorporata da piccole micelle di grasso e di sali biliari.
Per essere attiva la vitamina D3 deve essere biidrossilata:
- prima a livello epatico, con formazione del 25 idrossi-colecalciferolo, 25(OH)D3, ad opera dell'enzima mitocondriale epatico 25-alfa-idrossilasi:
- quindi a livello renale con formazione del 1,25 di-idrossi-colecalciferolo, 1,25(OH)2D3, ad opera dell'enzima mitocondriale renale 1-alfa-idrossilasi: questo enzima è sensibile all'ipocalcemia, all'ipofosfatasemia e ad un aumento della concentrazione del PTH.
La vitamina D3 agisce a tre livelli:
- a livello osseo determina un aumento della percentuale di matrice ossea calcificata;
- a livello intestinale aumenta l'assorbimento di calcio e fosforo;
- a livello renale diminuisce l'escrezione di calcio e fosfati.
Tecniche di misurazione della massa ossea
Per molti anni la diagnosi di osteoporosi è stata posta sulla base del riscontro clinico di una frattura patologica e dell'aspetto radiologico di un'intensa perdita di tono calcico, accompagnata o meno da fratture tipiche. Con l'esame radiografico si potevano infatti azzardare solamente delle conclusioni di massima circa la mineralizzazione del segmento osseo in esame, giacchè la certezza della sua riduzione poteva aversi solamente quando almeno il 30% della massa ossea fosse andata perduta. Si è quindi reso necessario passare da metodi di indagine qualitativa a metodi quantitativi, e questo ha portato alla nascita di misurazioni ed indici applicati alla tradizionale radiologia. L'esigenza di giungere allo sviluppo di metodi più affidabili ed efficaci ha successivamente indirizzato verso tecnologie diverse e più sofisticate in grado di dare un significato clinico anche a lievi variazioni della densità ossea. In questi ultimi anni sono quindi state sviluppate nuove tecniche per misurare la densità dell'osso, che comprendono la Mineralometria Ossea Computerizzata (MOC) a singolo ed a doppio raggio fotonico, la MOC digitale a raggi X, la Tomografia Assiale Computerizzata (TAC) Quantitativa e l'Attivazione Neutronica. Altri metodi, quali gli ultrasuoni o la scansione ad effetto Compton, sono per ora solo tentativi sperimentali.
Mineralometria Ossea Computerizzata (MOC)
I principi di funzionamento di tutti gli apparecchi di Mineralometria Ossea sono simili. E' noto come un fascio di radiazioni, quando attraversa qualunque materiale, viene rallentato nella sua corsa (legge dell'attenuazione fotonica). Questo fenomeno, valutato comparativamente, consente di analizzare le caratteristiche del materiale attraversato. Da un punto di vista tecnico, i vari tipi di MOC si differenziano proprio per il metodo di comparazione dei risultati adottato. Esistono in successione tre generazioni di apparecchi:
- densitometria a singolo raggio fotonico, o monocromatica: esiste un'unica fonte radioattiva che attraversa il materiale esaminato; per un'esatta comparazione è necessario uniformare lo spessore dei tessuti ricorrendo alla compressione o, più spesso, ad elementi che simulino i tessuti molli;
- densitometria a doppio raggio fotonico, o dicromatica: esistono o due fonti radioattive o un'unica fonte dotata di duplice emissione fotonica e questo è sufficiente per ottenere una comparazione attendibile;
- densitometria a raggi X: mantiene il medesimo principio del confronto tra due bande di emissioni fotoniche attraverso una schermatura adeguata del fascio policromatico e/o attraverso un confronto continuo (pixel per pixel) con campioni di densità nota.
E' possibile proporre un confronto tra i diversi tipi di MOC e tra queste e le altre metodiche a maggior diffusione (Tabella 5). Definiamo quindi alcuni elementi di paragone, che riguardano le caratteristiche di uno strumento di misurazione per fenomeni biologici, e sono quindi applicabili a qualunque altra metodica di esame:
- sensibilità: capacità di uno strumento di separare fenomeni diversi (nel caso particolare: una popolazione normale da una patologica, ma anche variazioni nel tempo nel medesimo soggetto, sia pur ridotte);
- accuratezza: capacità di uno strumento di misurare il valore reale del fenomeno che si intende valutare (nel caso particolare: il valore assoluto della mineralizzazione del segmento scheletrico indagato);
- precisione: capacità di uno strumento di riprodurre i medesimi risultati nel tempo.
| SPA | DPA | DEXA | QCT | |
| Regione valutabile | ||||
| Avambraccio | Sì | Sì | Sì | |
| Vertebre | Sì | Sì | Sì | |
| Femore | Sì | Sì | ||
| Scheletro in toto (Total Body) | Sì | Sì | ||
| Tempo di esecuzione (min) | 5 - 10 | 15 - 45 | 3 - 15 | 15 - 30 |
| Irradiazione del paziente (mRem) | < 3 | 3 - 5 | <3 | 200 - 500 |
| Precisione (%) | 1,5 - 3 | 4 | 0,4 - 1,5 | 2 - 4 |
| Accuratezza (%) | 5 - 10 | 5 - 10 | 4 - 8 | 5 - 30 |
Tabella 5
Confronto tra le metodiche di misurazione della massa ossea
(SPA: Densitometria a singolo raggio fotonico - DPA: Densitometria a doppio raggio fotonico - DEXA: Densitometria digitale a raggi X - (QCT) Tomografia Assiale Computerizzata Quantitativa ed Attivazione neutronica)
Quindi, la sensibilità si riferisce ad una capacità di discriminazione, l'accuratezza ad una di misurazione, la precisione ad una di ripetibilità. Un apparecchio poco sensibile non permette di distinguere, uno poco accurato non misura un unico fenomeno reale, uno poco preciso dà risultati differenti ad ogni esame.
Densitometria a singolo raggio fotonico (SPA)
La MOC a singolo raggio fotonico (figura 5), che viene abbreviata con SPA dall'inglese Single Photon Absorptiometry, permette di studiare la massa ossea di segmenti scheletrici periferici. Le parti di scheletro generalmente indagate sono le ossa dell'avambraccio. I radioisotopi utilizzati sono lo Iodio 125 o l'Americio 241. I vantaggi principali della SPA sono la semplicità e la brevità dell'esame, oltre al costo contenuto. Per ogni esame si impiegano circa 5-10 minuti e la dose di radiazioni è di circa 3 mRem. La SPA trova la sua massima applicazione nello screening di primo livello delle patologie demineralizzanti e nei controlli a distanza dei pazienti che non presentano particolari problemi diagnostici.
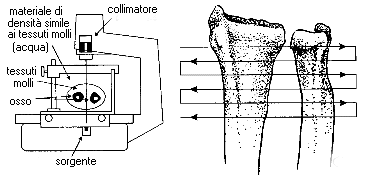
Figura 5
Mineralometro a singolo raggio fotonico e zona di scansione
Densitometria a doppio raggio fotonico (DPA)
La necessità di effettuare delle misurazioni dirette, in vivo, della densità ossea dello scheletro assile e di altre strutture, come il collo del femore, frequentemente coinvolte in fratture patologiche, ha portato all'evoluzione della densitometria a singolo raggio fotonico. Vennero elaborati quindi degli strumenti forniti di una fonte di emissione radioattiva a due diverse energie che permettesse l'indagine anche nelle aree ove fosse presente uno strato di tessuti molli di spessore elevato o variabile. Tra questi strumenti, ricordiamo quello costituito dalla combinazione di due radioisotopi, come l'Americio 241 e il Cesio 137, oppure quelli caratterizzati da sorgenti con un unico radioemittente, come il Gadolinio 153, dotato di una duplice emissione di fotoni; quest'ultima rappresenta la soluzione più largamente adottata, in quanto fornisce risultati migliori. La MOC a doppio raggio fotonico, o DPA dall'inglese Dual Photon Absorptiometry, viene utilizzata nello studio della colonna vertebrale lombare e del femore. La durata dell'esame varia da 15 a 40 minuti circa, in relazione allo stato della sorgente ed alle dimensioni corporee del paziente. La dose di radiazione assorbita per esame è anche qui molto modesta, e si aggira sui 35 mRem. Le indicazioni clinicheriguardano tutte le patologie demineralizzanti come screening di secondo livello e come controllo dei pazienti in terapia.
Densitometria digitale a raggi X (DEXA)
Il costo delle sorgenti radioattive, i problemi connessi al decadimento ed alla purezza delle sorgenti hanno spinto allo sviluppo di tecniche densitometriche che impiegano raggi X. In questi ultimi anni è stato possibile, utilizzando filtri a terre rare o effettuando confronti continui sul medesimo pixel esaminato, ricorrere a queste metodiche. La MOC digitale a raggi X, o DEXA dall'inglese Dual Energy XRay Absorptiometry, permette di studiare la porzione prossimale del femore e la colonna vertebrale lombare anche in laterale, evitando così parte delle sovrastime dei dati dovute all'artrosi della porzione posteriore della vertebra. Tale metodica permette anche di effettuare un'indagine Total Body con tempi relativamente brevi: circa 15-18 minuti. L'elevata velocità di scansione permette di effettuare un esame alla colonna lombare in circa 57 minuti con una dose di radiazioni per il paziente trascurabile: meno di 3 mRem. Queste caratteristiche rendono l'esame particolarmente indicato ad un esteso uso clinico sia per le indagini di primo livello sia per i controlli dei pazienti a rischio e di quelli già in terapia.
Tomografia Assiale Computerizzata Quantitativa (QCT) ed Attivazione neutronica (AN)
E' possibile effettuare la valutazione del contenuto minerale osseo anche con la TAC. Questo strumento produce immagini delle strutture anatomiche secondo una scala di grigi denominata di Hounsfield, proporzionale alla densità di ogni struttura rappresentata. La velocità di esecuzione è discreta (515 minuti) ma la dose di radiazione assorbita, pari a 100-500 mRem, ed il costo per esame, riducono la diffusione di tale metodica che, data l'elevata invasività, deve essere destinata ai casi di una certa gravità e non certo come primo accertamento, né per il follow-up dei soggetti a rischio. Le indicazioni cliniche per questo tipo di indagine sono quindi più limitate di quelle descritte per la DEXA.
Con l'Attivazione Neutronica (AN) è possibile misurare in vivo il contenuto totale di calcio nell'organismo. La AN è una metodica molto precisa ed accurata, ma l'elevatissimo costo della strumentazione e l'irradiazione a cui viene sottoposto il paziente (2.000-5.000 mRem) hanno notevolmente limitato il suo sviluppo. Il suo uso è, in pratica, esclusivamente destinato alla ricerca.
Scelta del metodo di misurazione della massa ossea
Secondo quanto esposto, attualmente le più appropriate metodiche di indagine della massa ossea sono quelle densitometriche radioisotopiche o radiologiche, riservando ad una seconda scelta la QCT. Di fronte ad un soggetto con possibile osteopenia, l'esame più indicato è la SPA, per la sua affidabilità, il basso costo e la facilità di esecuzione. Se i risultati così ottenuti non dirimono tutti i dubbi, si può ricorrere alla DPA od alla DEXA della colonna vertebrale.
In tutti i soggetti con osteopenia in atto, e a maggior ragione, nei pazienti in terapia, è conveniente il controllo periodico sia dello scheletro appendicolare (SPA) che assile (DPA / DEXA alla colonna lombare).
Le indagini in distretti particolari, come il collo del femore, od altre sedi derivabili da un'indagine tipo "Total Body", sono utili a risolvere quesiti circa il possibile rischio locale di frattura. In particolare, lo studio del femore prossimale può essere l'esame di prima scelta nei soggetti anziani, specie se colpiti da importante artrosi vertebrale lombare.
Iter diagnostico per osteoporosi postmenopausale
L'iter diagnostico dell'osteoporosi postmenopausale deve basarsi su tre fasi integrate fra loro: L'esame clinico, le indagini strumentali, le indagini di laboratorio (Tabella 6).
L'esame clinico, attraverso l'anamnesi e l'esame obbiettivo, consente di mettere in evidenza i possibili fattori di rischio; in certi casi sarà possibile rilevare i segni tipici di un'osteoporosi già in atto: sede e modalità di comparsa delle eventuali pregresse fratture, perdita di statura, ipercifosi dorsale, tipo di dolore scheletrico. Tutte queste informazioni sono essenziali non solo per una corretta diagnosi, ma anche per orientare ulteriori accertamenti diagnostici differenziali e per ottimizzare gli indirizzi terapeutici.
Le indagini strumentali si avvalgono sostanzialmente della mineralometria ossea computerizzata, della radiologia classica e della scintigrafia ossea. Si possono dividere in due livelli: le indagini strumentali di secondo livello possono essere riservate ai casi in cui esista la necessità di effettuare una diagnosi differenziale.
Nell'osteoporosi postmenopausale e senile gli indici di laboratorio sono nella norma. Tuttavia, alcuni parametri biochimici del metabolismo fosfocalcico sono indispensabili per riconoscere la presenza di importanti alterazioni della sua omeostasi (iper o ipoparatiroidismo, osteomalacia, etc.) e per una valutazione generale del turnover osseo. Le indagini di secondo livello, più specifiche, ma in certi casi anche meno reperibili, possono essere riservate ai casi in cui esistano dei sospetti mirati. Nei casi in cui l'anamnesi o l'obiettività indichino la possibilitàdi patologie associate che interferiscano con il metabolismo osseo, le valutazioni di laboratorio più specifiche saranno di grande aiuto per inquadrare il singolo caso clinico.
| Esame clinico | |
| Anamnesi | Esame obiettivo |
| Età | Peso |
| Menopausa | Altezza |
| Alimentazione | Ispezione scheletro |
| Attività fisica | Dolore osteoarticolare spontaneo |
| Patologie in atto | Dolore osteoarticolare provocato |
| Fratture pregresse | |
| Uso di farmaci | |
| Sintomatologia scheletrica | |
| Indagini strumentali | |
| I livello | II livello |
| MOC avambraccio o rachide lombare (perimenopausa) | Radiografia di diversi distretti scheletrici per diagnosi differenziale |
| MOC femore prossimale o Total Body (pazienti oltre i 70 anni) | Scintigrafia ossea per diagnosi differenziale vs. Paget neoplasie |
| Radiografia del rachide dorsolombare in proiezione P/A ed L/L (se si sospettano fratture) | |
| Indagini di laboratorio | |
| I livello | II livello |
| Calcemia | Paratormone intatto |
| Fosforemia | Osteocalcina |
| Fosfatasi alcalina | Metaboliti Vitamina D |
| Calciuria | Parametri bioumorali specifici per diagnosi differenziale con altre patologie |
| Fosfaturia | |
| Idrossiprolinuria | |
Tabella 6
Iter diagnostico nell'osteoporosi postmenopausale
Prevenzione
La prevenzione rappresenta l'approccio più razionale e moderno al problema dell'osteoporosi e la diagnosi precoce costituisce uno dei fondamenti indispensabili. La malattia si presenta in due modi distinti:
- per un periodo variabilmente lungo, ma che dura almeno qualche anno, è presente solo sul piano metabolico;
- inizia in seguito la fase sintomatica, con la manifestazione più evidente: le fratture.
Nella prima fase c'è il tempo sufficiente ad instaurare trattamenti che prevengano la sua evoluzione, soprattutto quando si pensa che:
- le fratture di femore nell'anziano hanno spesso prognosi infausta, non solo "quoad valetudinem", ma purtroppo anche "quoad vitam";
- le fratture vertebrali non consentono una "restitutio ad integrum";
- anche le terapie più moderne consentono solo recuperi marginali per quanto riguarda la massa ossea perduta, potendo soltanto arrestare o rallentare l'evoluzione della patologia.
L'obbiettivo deve quindi essere quello di non far scendere la massa ossea al di sotto della "soglia di frattura". Per raggiungere questo obbiettivo è indispensabile anticipare quanto più possibile la diagnosi.
Tratto da: L'attività fisica nella prevenzione dell'osteoporosi.
Monografia pubblicata dal Gruppo di Studio della scoliosi nel 1993,
a cura di Stefano Negrini, Sergio Ortolani, Giorgio Gandolini, Carlo Trevisan.
Ultima modifica: 7/1/1998



